Déclarer les évènements indésirables:
Les évènements indésirables doivent être déclarés au groupe CSL Vifor.
pv.vif@viforpharma.com

I am practicing from:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other
I am residing in:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other

Bitte verwenden Sie als Benutzernamen die E-Mail Adresse, welche Sie bei der Registration angegeben hatten. Falls Sie das Passwort vergessen haben, können Sie sich einen Reaktivierungslink zustellen lassen. Alternativ ist für bereits registrierte Health Professionals auch eine Anmeldung mit der HPC-Card von FMH oder pharmaSuisse möglich.
L'hyperkaliémie est définie comme un taux de K+ sérique > 5 mmol/L. Il s’agit d’une affection grave associée à une morbidité et à une mortalité élevées1-6
Les évènements indésirables doivent être déclarés au groupe CSL Vifor.
pv.vif@viforpharma.com
![]()
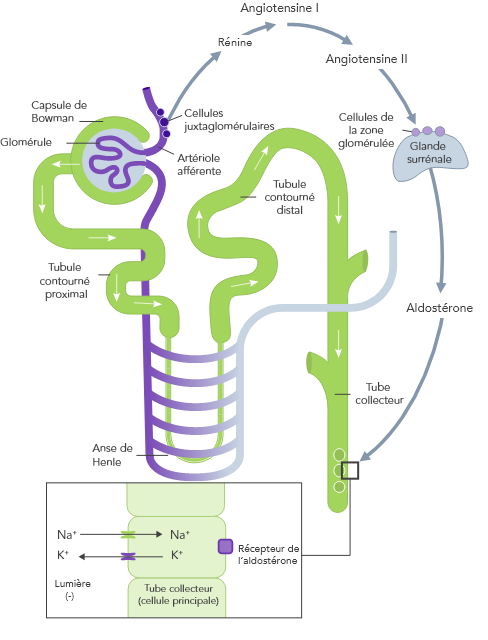
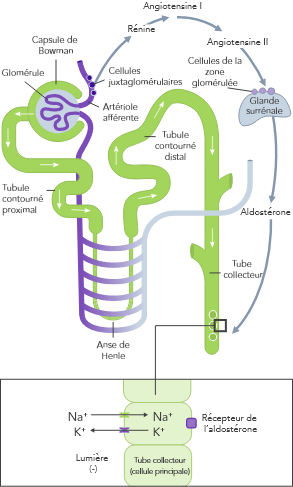
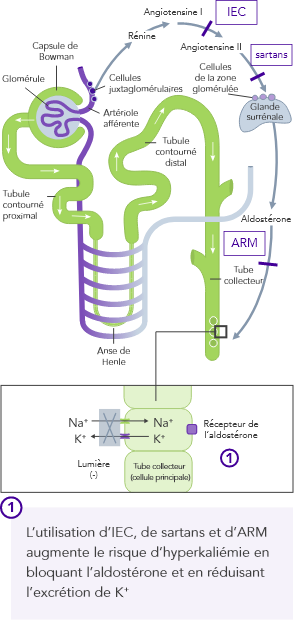
L’homéostasie du K+ s’obtient par des mécanismes de contrôle à court et à long terme.7,10
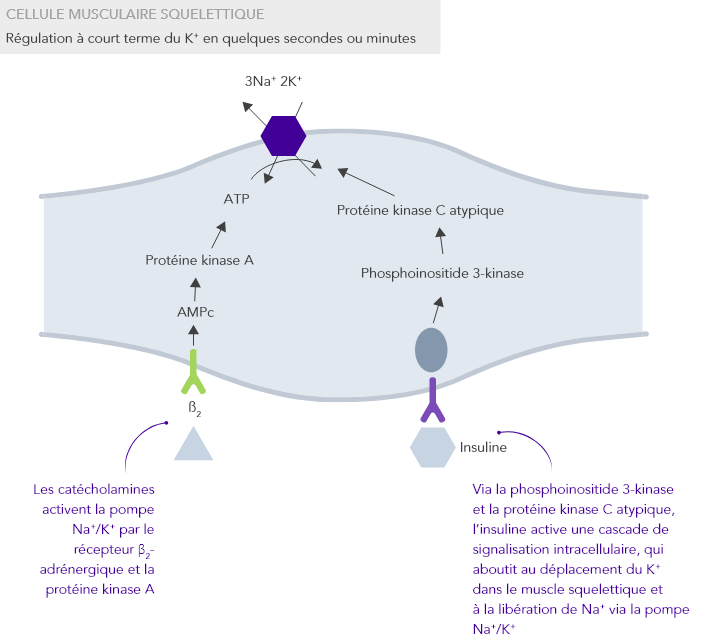
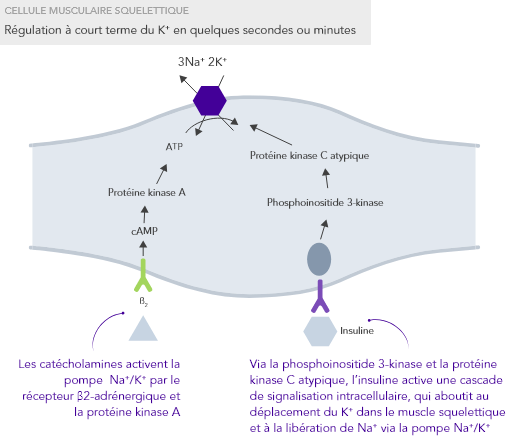
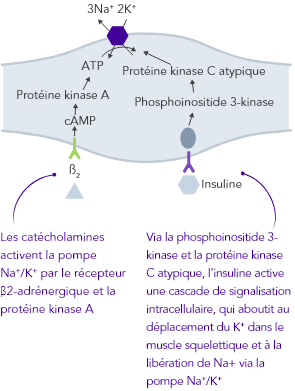
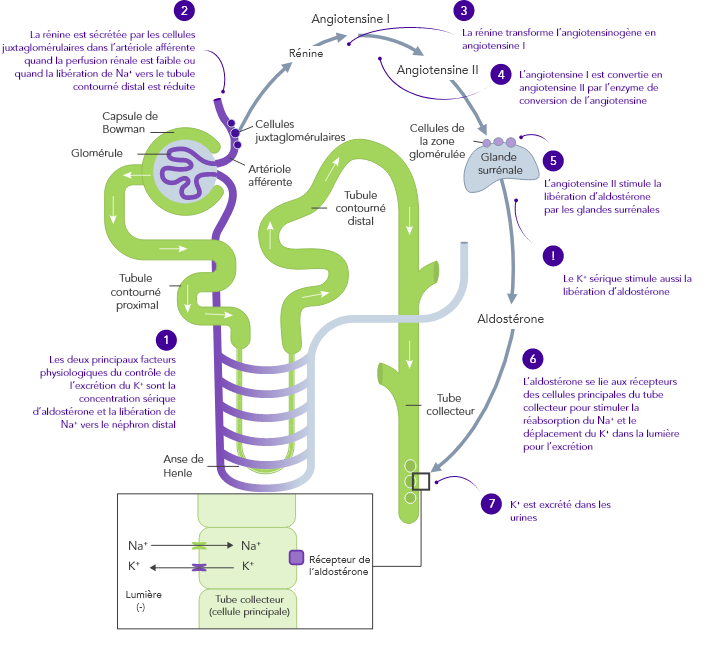
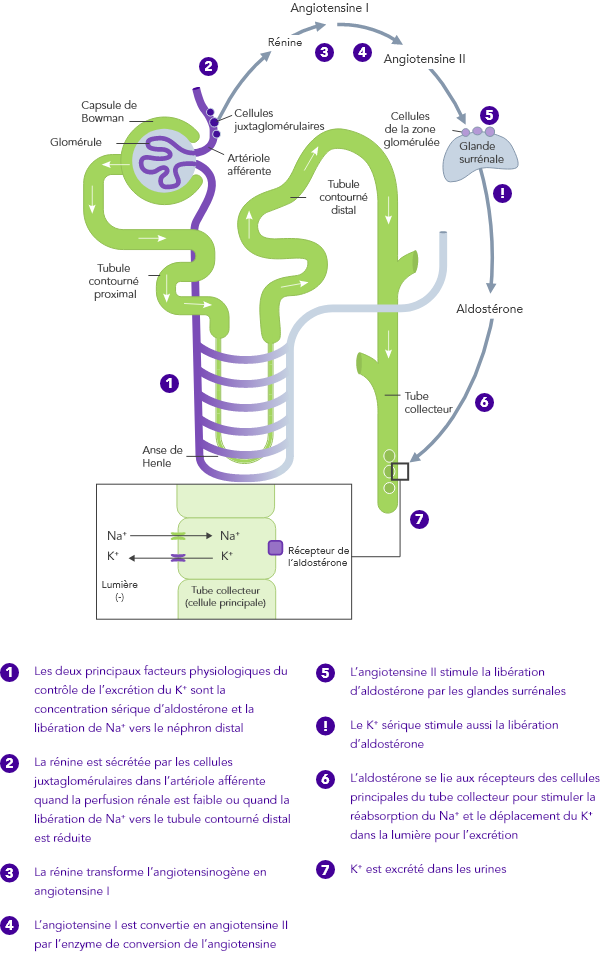
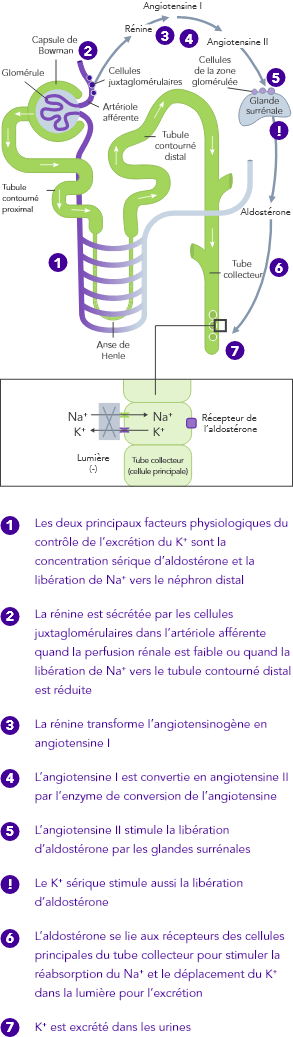
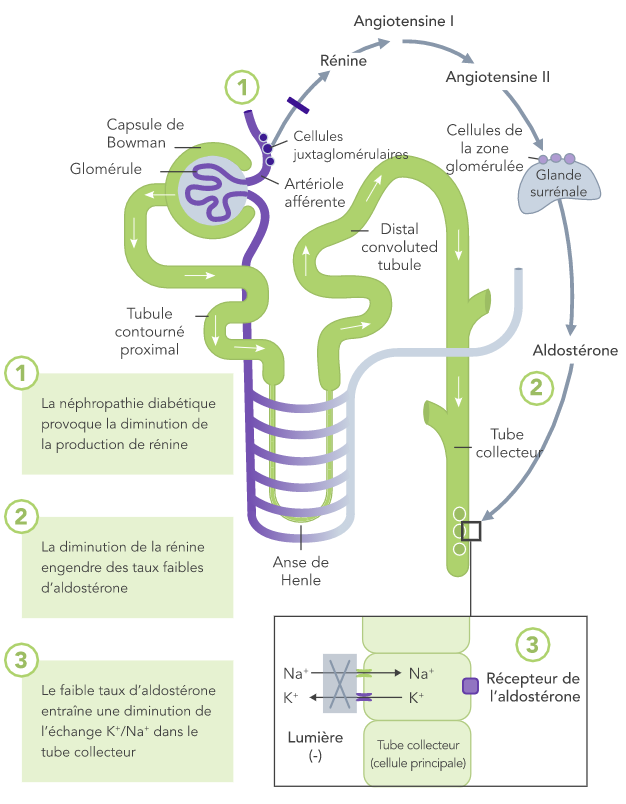
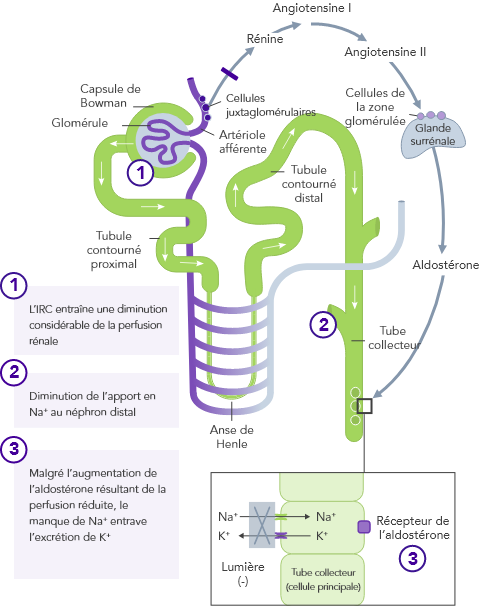
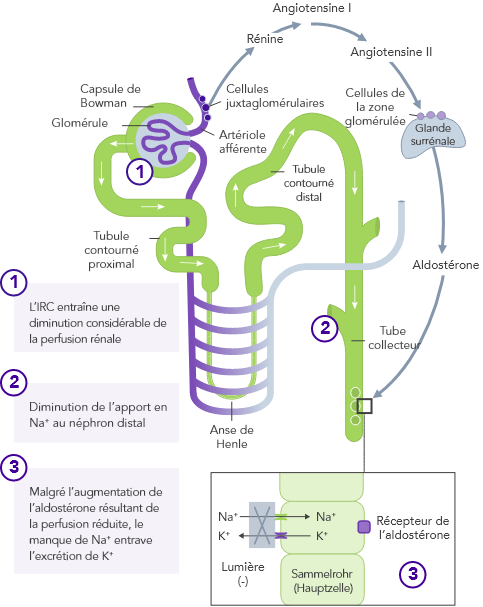
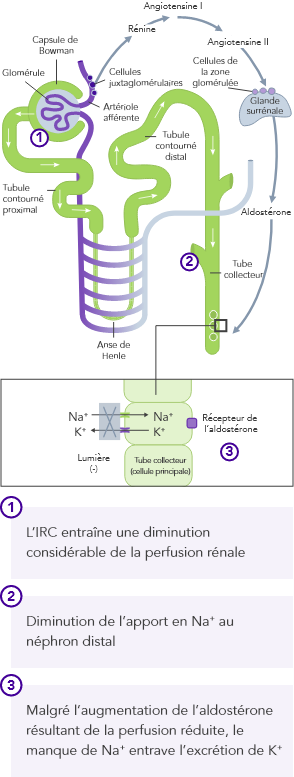
Insuffisance rénale chronique
En cas d’IRC, l’homéostasie du K+, ayant lieu principalement par l’excrétion urinaire du K+, est dérégulée et peut entraîner une hyperkaliémie
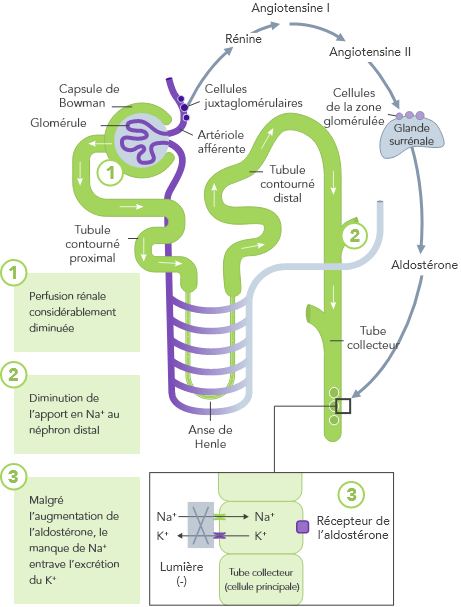
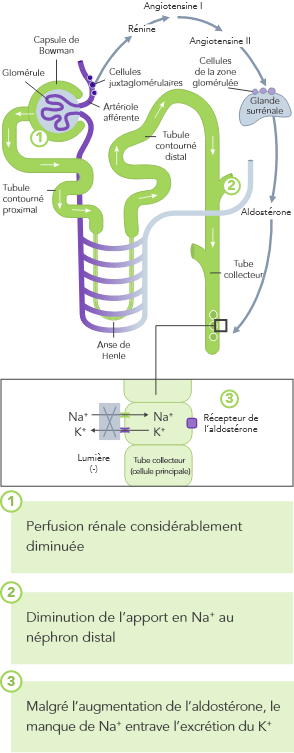
Insuffisance cardiaque
En cas d’IC, le SRAA est régulé à la hausse, la perfusion rénale est diminuée et le Na+ est souvent excrété à cause de la prise de diurétiques
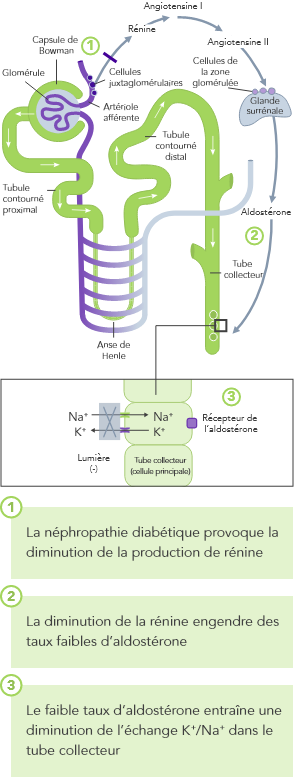
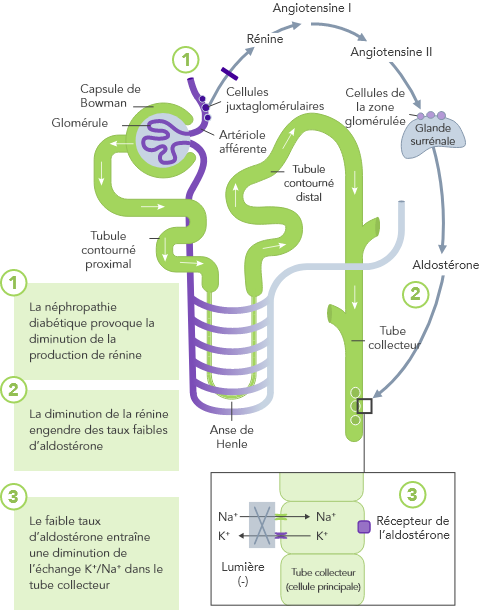
Diabète
Dû à l’insuffisance de la capture de K+ médiée par la pompe Na+/K+ et stimulée par l’insuline dans les muscles squelettiques
Âge
La diminution de la disponibilité des néphrons due à l’âge augmente aussi le risque d’hyperkaliémie
Médicaments
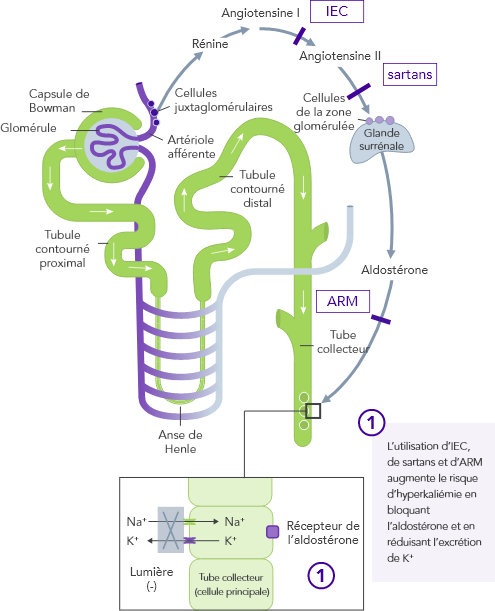
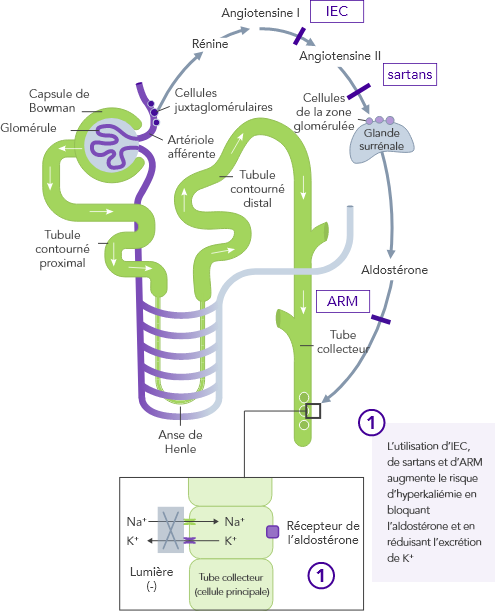
L’utilisation d’un traitement de fond par inhibiteurs du SRAA, bêtabloquants et antagonistes de l’aldostérone est associée à une augmentation des taux de K+
Activité physique
Comme les muscles squelettiques sont le principal réservoir de K+ du corps, les taux de K+ peuvent augmenter nettement et atteindre des valeurs allant jusqu’à ~8 mmol/L pendant l’activité physique
Apport en K+
L’apport oral de K+ associé à la diminution de son excrétion peut augmenter le risque d’hyperkaliémie
L’hyperkaliémie est l’une des anomalies électrolytiques les plus importantes du point de vue clinique. Il s’agit d’une affection grave associée à une augmentation de la mortalité et à des taux élevés d’hospitalisation.1,3,4,6
Un examen rétrospectif ciblé des dossiers de 1’457 patients atteints d’hyperkaliémie issus de 5 centres en Europe a indiqué que l’hyperkaliémie était responsable de plus d’un tiers des hospitalisations sur une période de 12 mois.6

36%
Liées à
l’hyperkaliémie
![]()
1,457
Patients
![]()
72%
atteints
d’hypertension
artérielle
![]()
68%
atteints
d’IRC
![]()
40%
atteints
d’IC
![]()
36%
atteints
de diabète
de type 2
![]()
60.5%
sous
inhibiteurs du
SRAA
Les effets de l’hyperkaliémie sont très variables selon les patients,15 allant de symptômes légers et non spécifiques (p. ex. faiblesse musculaire, spasmes musculaires, crampes, nausées, vomissements) à des arythmies, des palpitations, des vertiges, une syncope et une mort subite d’origine cardiaque.3,16
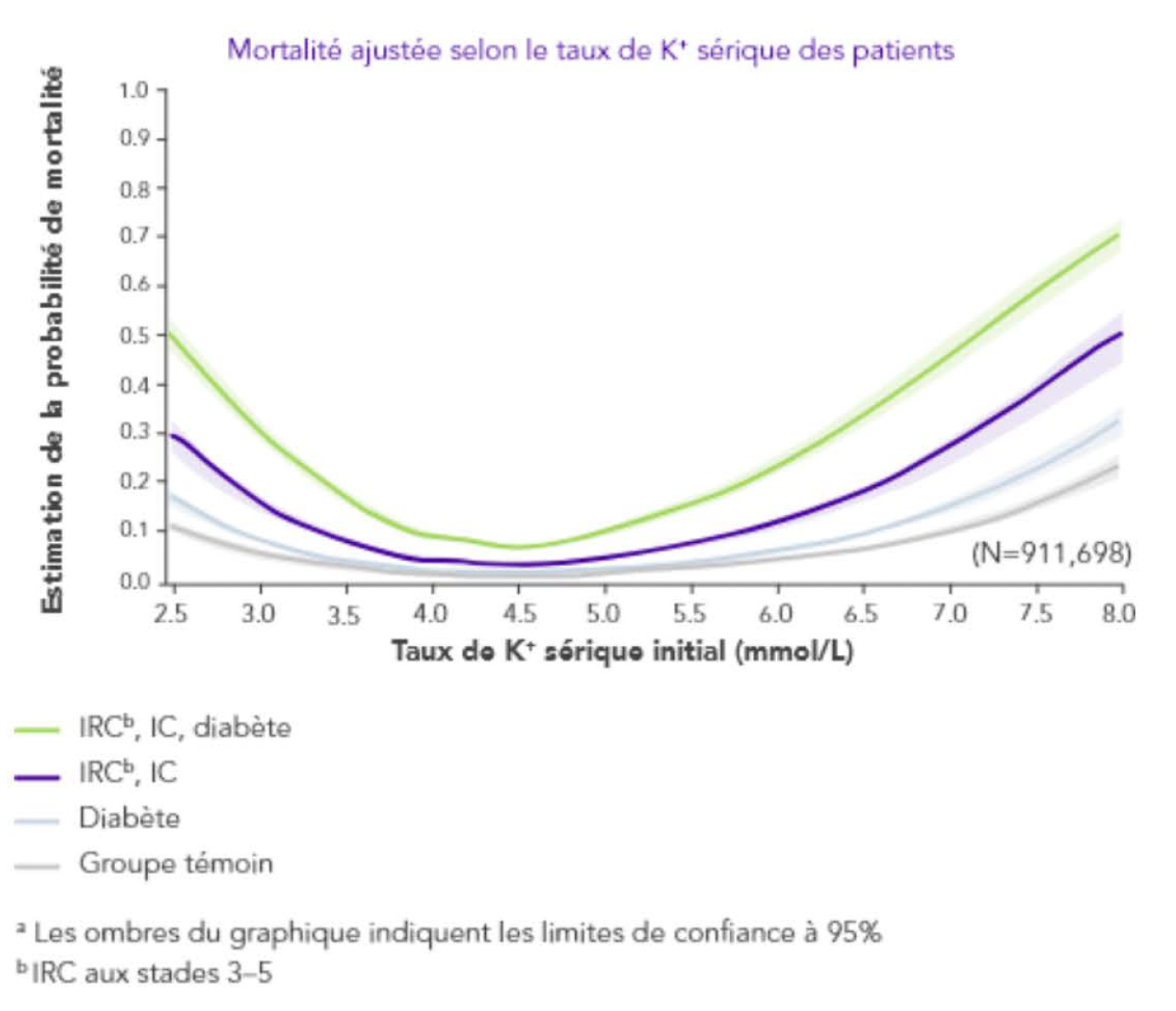
Même si la gravité de la présentation clinique est généralement corrélée au degré de l’hyperkaliémie,2 l’adaptation physiologique, la maladie cardiaque structurelle, l’utilisation de médicaments et le degré de la maladie concomitante peuvent prédisposer certains patients atteints d’hyperkaliémie à un seuil plus faible ou plus élevé de toxicité.17

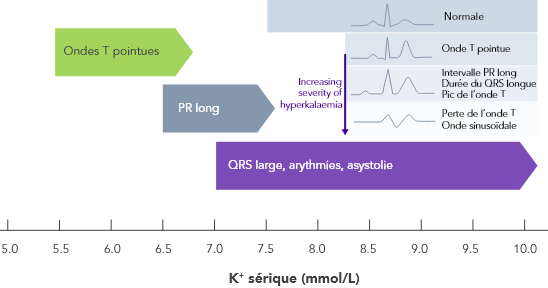
Point important, l’hyperkaliémie est souvent asymptomatique jusqu’à ce que le patient présente des conséquences graves.2,16 Il n’y a pas toujours de modifications de l’ECG, mais celles-ci peuvent progresser rapidement sans signes avant-coureurs. L’hyperkaliémie associée à des modifications de l’ECG est une urgence médicale absolue.2
L’IRC est le facteur de risque le plus fréquent d’hyperkaliémie.
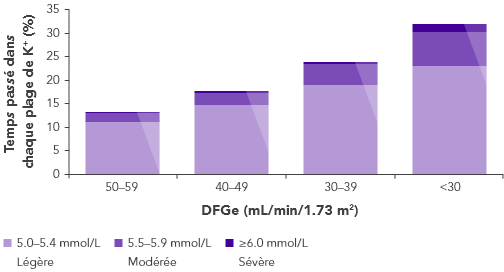
Chez les patients atteints d’IRC, la capacité à maintenir l’homéostasie du K+ est compromise du fait de la diminution du DFG. Cela entraîne une augmentation du risque d’hyperkaliémie.






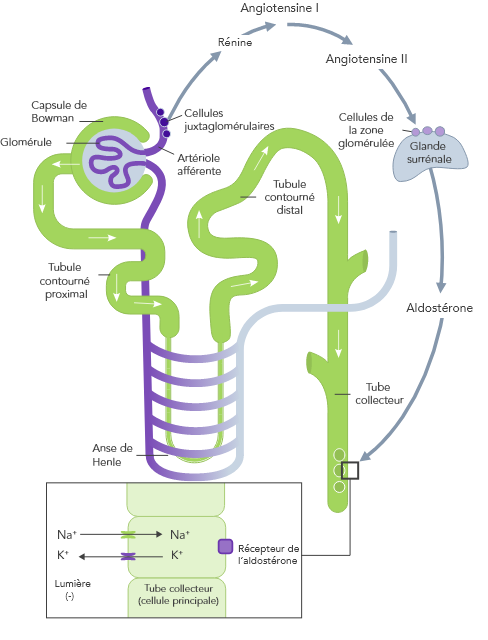
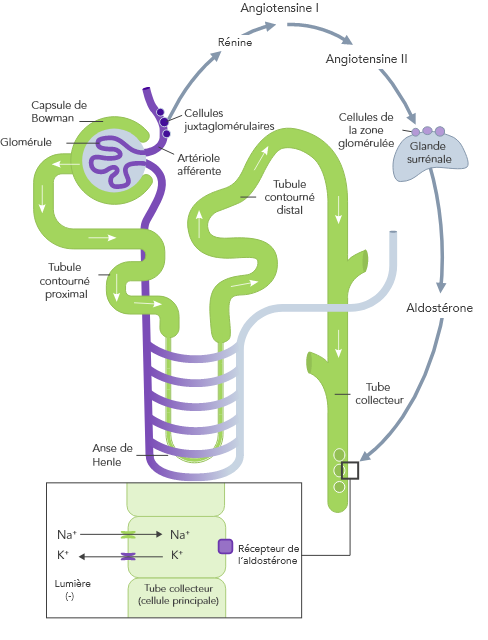
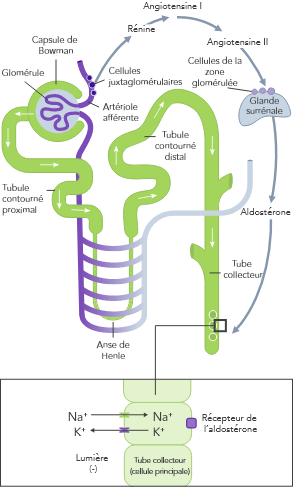
L’hyperkaliémie chronique nécessite une prise en charge continue visant à corriger les troubles sous-jacents de l’équilibre potassique.21
Les symptômes d’hyperkaliémie peuvent apparaître soudainement22 et exiger un traitement urgent.
L’hyperkaliémie entraîne souvent la titration à la baisse des inhibiteurs du SRAA ou leur interruption, toutes deux associées à de mauvais résultats chez les patients atteints d’IRC.25,26
Près de 4 patients sur 10 atteints d’IC auront une hyperkaliémie27,28. Il s’agit souvent d’épisodes récurrents de plus en plus rapprochés dans le temps.27
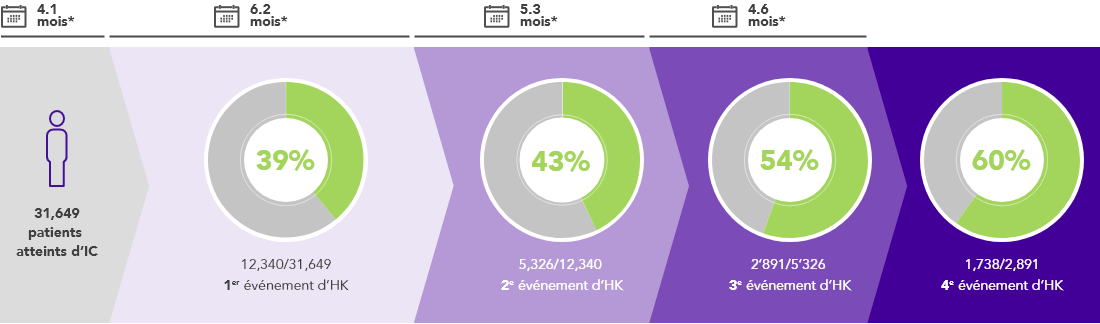
*Suivi médian
Les patients atteints d’IC ont un risque d’hyperkaliémie, car environ un tiers à la moitié d’entre eux ont une fonction rénale altérée (DFGe <60 mL/min/1.73 m2).29






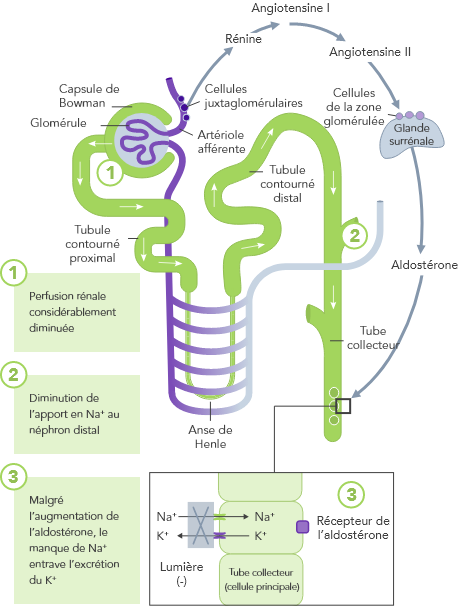
L’hyperkaliémie chronique nécessite une prise en charge continue visant à corriger les troubles sous-jacents de l’équilibre potassique.21
Une hyperkaliémie chronique ou d’apparition nouvelle chez les patients non dialysés atteints d’IRC induit un risque accru de néphropathie en phase terminale.24
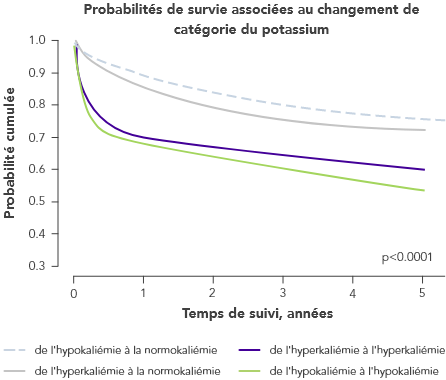
L’hyperkaliémie est associée à un accroissement de la mortalité toutes causes confondues pour tous les stades d’IRC5
IEC, inhibiteur de l’enzyme de conversion; cAMP, adénosine monophosphate cyclique; IC, intervalle de confiance; IRC, insuffisance rénale chronique; ECG, électrocardiogramme; DFG(e), débit de filtration glomérulaire (estimé); IC, insuffisance cardiaque; HK, hyperkaliémie; K+, ions potassium; mmol/L, millimoles par litre; ARM, antagoniste des récepteurs minéralocorticoïdes; Na+, ions sodium; SRAA, système rénine-angiotensine-aldostérone;
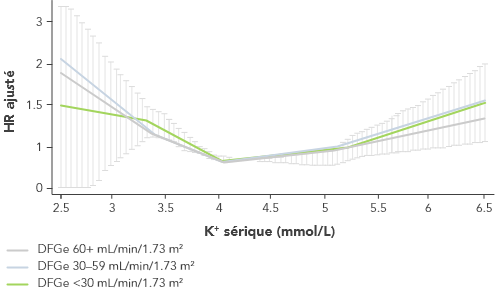
a L'ombrage dans le graphique indique un intervalle de confiance à 95%.
b l'IRC comprend les stades 3-5
1. Di Lullo L, et al. Cardiorenal Med 2019;9(1):8−21. 2. Rastegar A, Soleimani M. Postgrad Med J 2001;77(914):759−64. 3. Kjeldsen KP, Schmidt TA. Eur Heart J 2019;21(Suppl A):A2−A5. 4. Collins AJ, et al. Am J Nephrol 2017;46(3):213−21. 5. Kovesdy CP, et al. Eur Heart J 2018;39(17):1535−42. 6. Rossignol P, et al. Clin Kidney J 2020;13:714−9. 7. Clase CM, et al. Kidney Int 2020;97(1):42−61. 8. Youn JH, McDonough AA. Annu Rev Physiol 2009;71:381−401. 9. Palmer BF. Clin J Am Soc Nephrol 2015;10(6):1050−60. 10. Palmer BF. N Engl J Med 2004;351:585−92. 11. Mathialahan T, et al. J Pathol 2005;206:46−51. 12. Rosano GMC, et al. Eur Heart J Cardiovasc Pharmacother 2018;4(3):180−8. 13. Tromp J, van der Meer P. Eur Heart J 2019;21(Suppl A):A6−A11. 14. Palmer BF. In: Kimmel PL, Rosenberg M (Eds). 2015:386−7. 15. Welch A, et al. Nephrol Dial Transplant 2013;28(1):15−16. 16. Kraft MD, et al. Am J Health Syst Pharm 2005;62(16):1663−82. 17. Montford JR, Linas S. J Am Soc Nephrol 2017;28(11):3155−65. 18. Kashihara N, et al. Kidney Int Rep 2019;4(9):1248−60. 19. Einhorn LM, et al. Arch Intern Med 2009;169(12):1156−62. 20. Luo J, et al. Clin J Am Soc Nephrol 2016;11(1):90−100. 21. Kim GH. Electrolyte Blood Press 2019;17(1):1−6. 22. Dasgupta A. E-Journal of Cardiology Practice 2016;14, No 13. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-14/fourteen-thirteen. 23. Betts KA, et al. Kidney Int Rep 2018;3(2):385−93. 24. Provenzano M, et al. J Clin Med 2018;7:499. DOI:10.3390/jcm7120499. 25. Epstein M, et al. Am J Manag Care 2015;21(11 Suppl):S212−S220. 26. Yildirim T, et al. Ren Fail 2012;34(9):1095−9. 27. Thomsen RW, et al. J Am Heart Assoc 2018;7(11):e008912. 28. Savarese G, et al. JACC Heart Fail 2019;7(1):65−76. 29. Shlipak MG. Ann Intern Med 2003;138(11):917−24. 30. Núñez J, et al. Circulation 2018;137:1320–30. 31. Lund LH, Pitt B. Eur J Heart Fail 2018;20:931–2. 32. Martens P, et al. Acta Cardiol 2020; doi: 10.1080/00015385.2020.1771885.