Déclarer les évènements indésirables:
Les évènements indésirables doivent être déclarés au groupe CSL Vifor.
pv.vif@viforpharma.com

I am practicing from:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other
I am residing in:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other

Bitte verwenden Sie als Benutzernamen die E-Mail Adresse, welche Sie bei der Registration angegeben hatten. Falls Sie das Passwort vergessen haben, können Sie sich einen Reaktivierungslink zustellen lassen. Alternativ ist für bereits registrierte Health Professionals auch eine Anmeldung mit der HPC-Card von FMH oder pharmaSuisse möglich.
Contrôle durable du K+, possibilité d’utiliser le traitement par inhibiteurs du SRAA recommandé par les directives de façon démontrée1-11
Les évènements indésirables doivent être déclarés au groupe CSL Vifor.
pv.vif@viforpharma.com



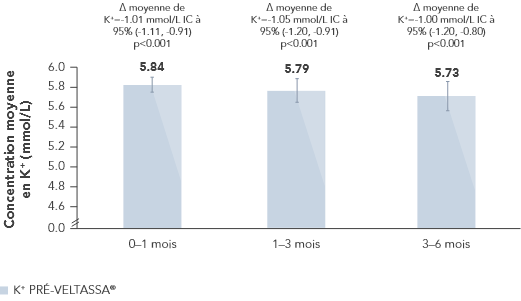
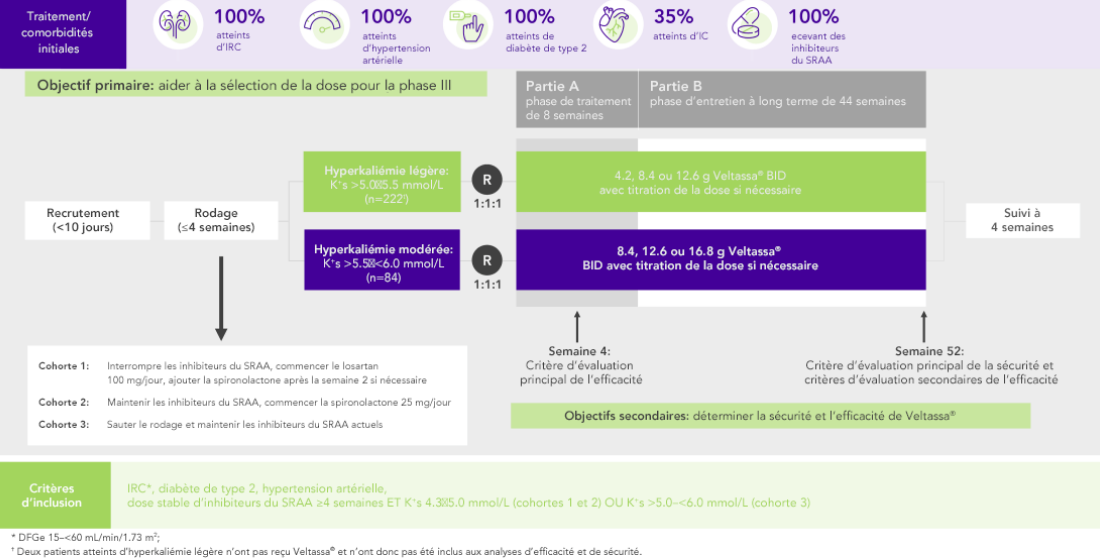
Chez 306 patients atteints de diabète de type 2, d’IRC et d’hypertension artérielle et traités par inhibiteurs du SRAA, on a observé des diminutions significatives du K+ sérique au bout de 4 semaines avec Veltassa®. Elles ont perduré pendant 1 an1 chez les patients suivants:
![]()
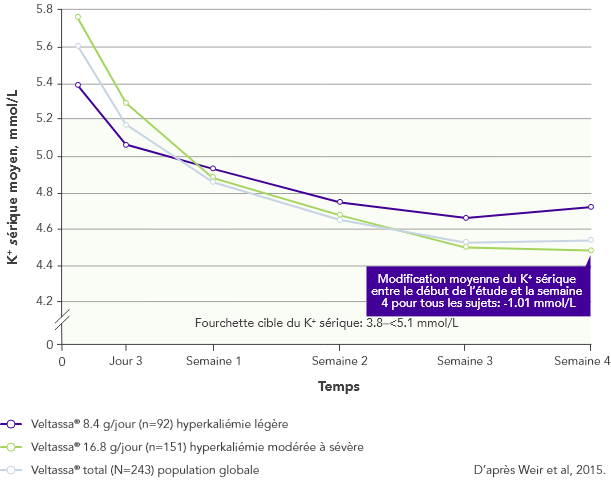

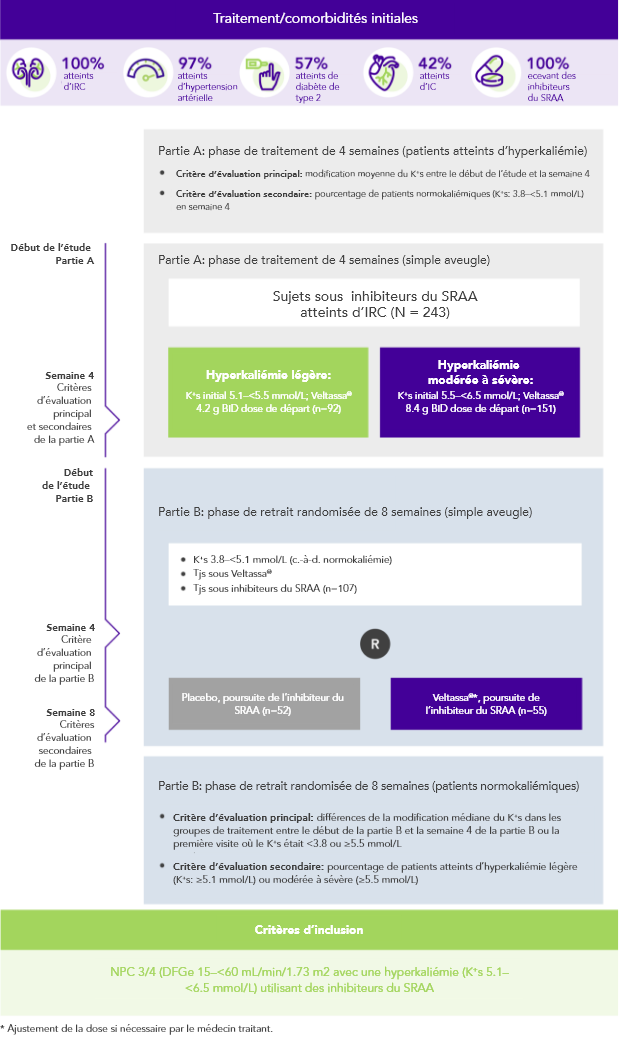
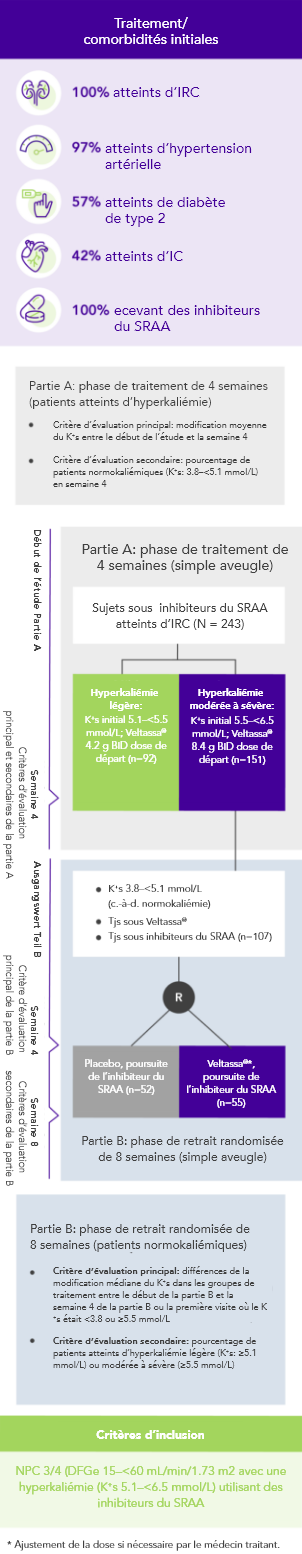
Chez 76% des 243 patients atteints d’IRC et d’hyperkaliémie et recevant des inhibiteurs du SRAA, le K+ sérique était dans la fourchette cible (3.8–<5.1 mmol/L) en semaine 42
Résultats similaires chez les patients présentant une:
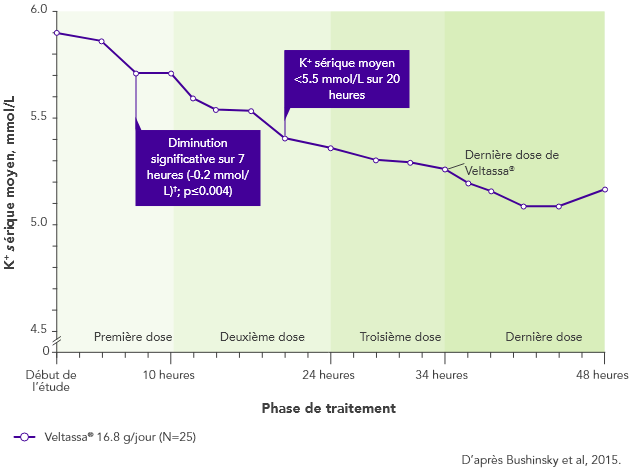

Chez les patients sous inhibiteurs du SRAA atteints d’IRC et d’hyperkaliémie, Veltassa® a permis d’obtenir des diminutions du K+ sérique 4 à 7 heures après la première dose3. Le taux moyen initial de K+ sérique avait diminué à tous les moments ultérieurs lors des 48 heures.
Le K+ sérique n’avait pas augmenté avant la dose suivante ni au cours des 24 heures suivant la dernière dose3
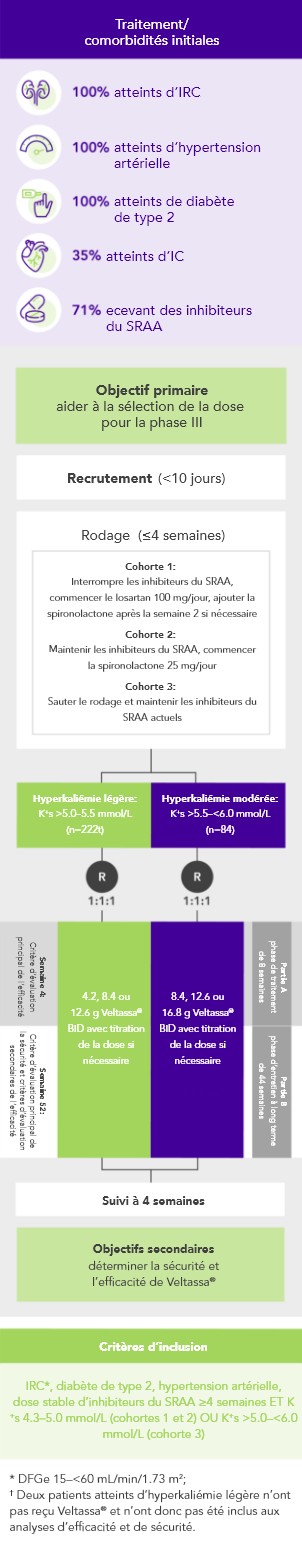
OPAL (N=243)2
100% sous inhibiteurs du SRAA; 42% IC; 100% IRC;
97% hypertension artérielle; 57% diabète de type 2
Pourcentage de patients recevant une dose d’inhibiteurs du SRAA à la semaine 8 de la phase de sevrage randomisée
(critère d’évaluation exploratoire)
![]()
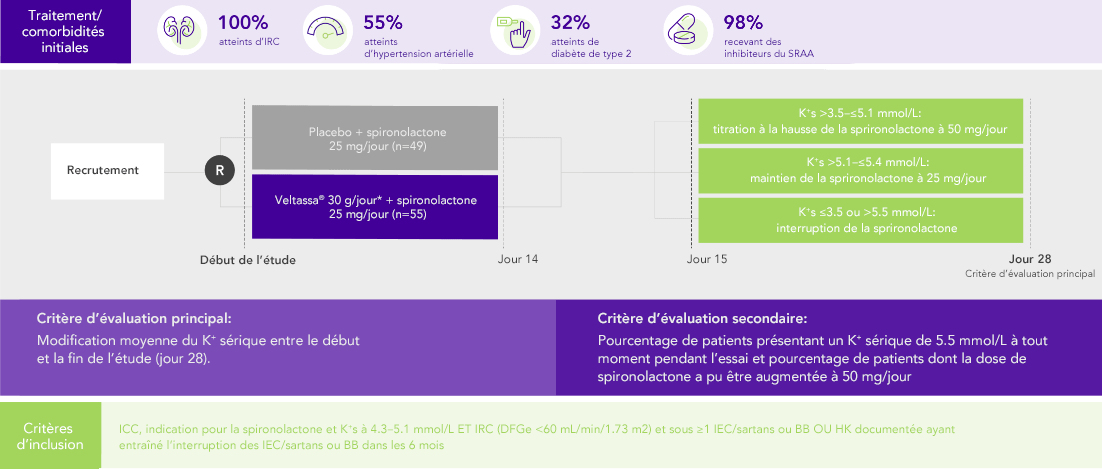
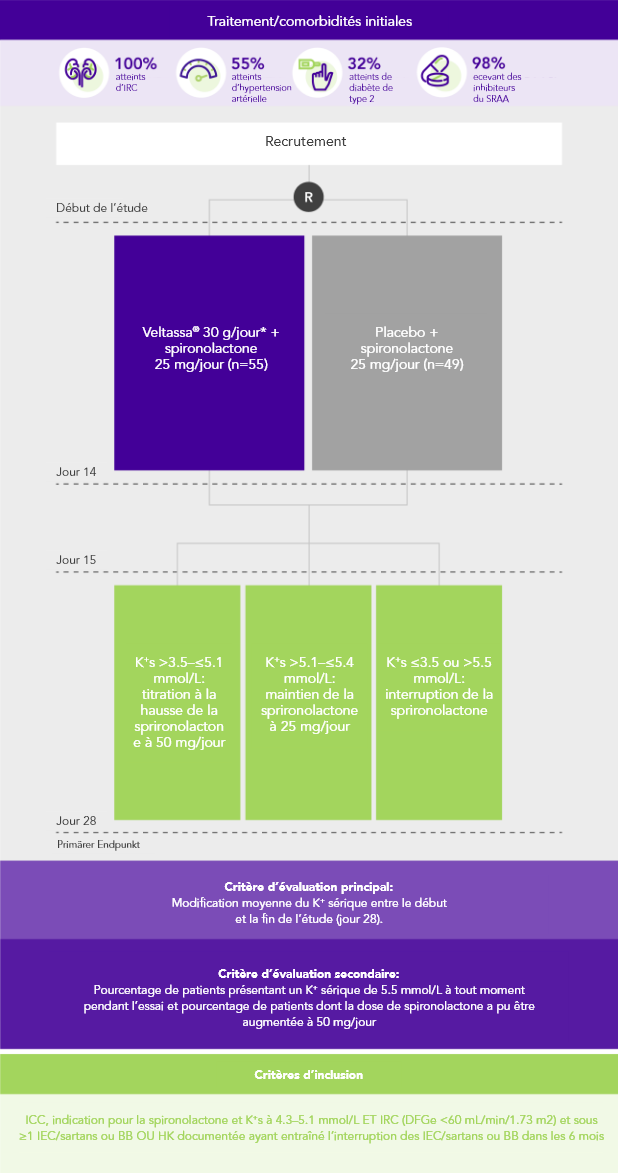
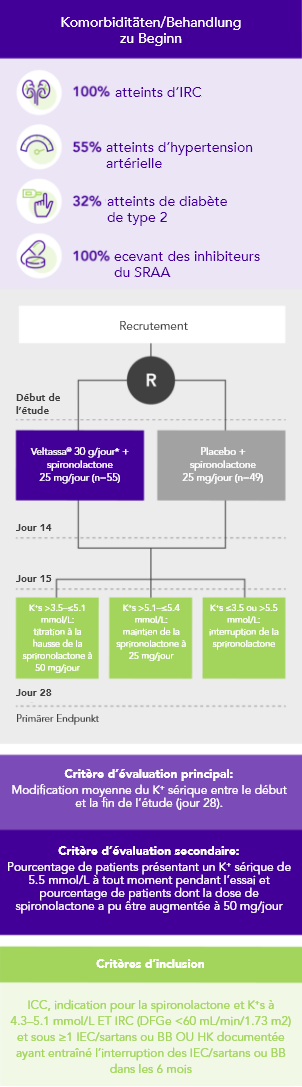
PEARL-HF (N=105)4
100% IC; 57% IRC; 32% diabète de type 2;
98% sous inhibiteurs du SRAA
Pourcentage de patients prenant une dose de sprironolactone augmentée à 50 mg/jour
(critère d’évaluation secondaire)
![]()
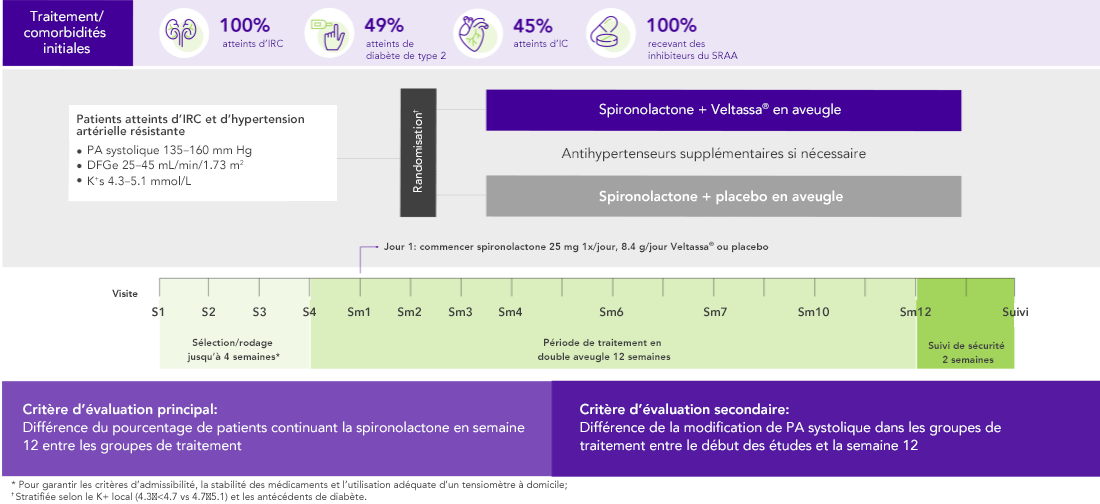
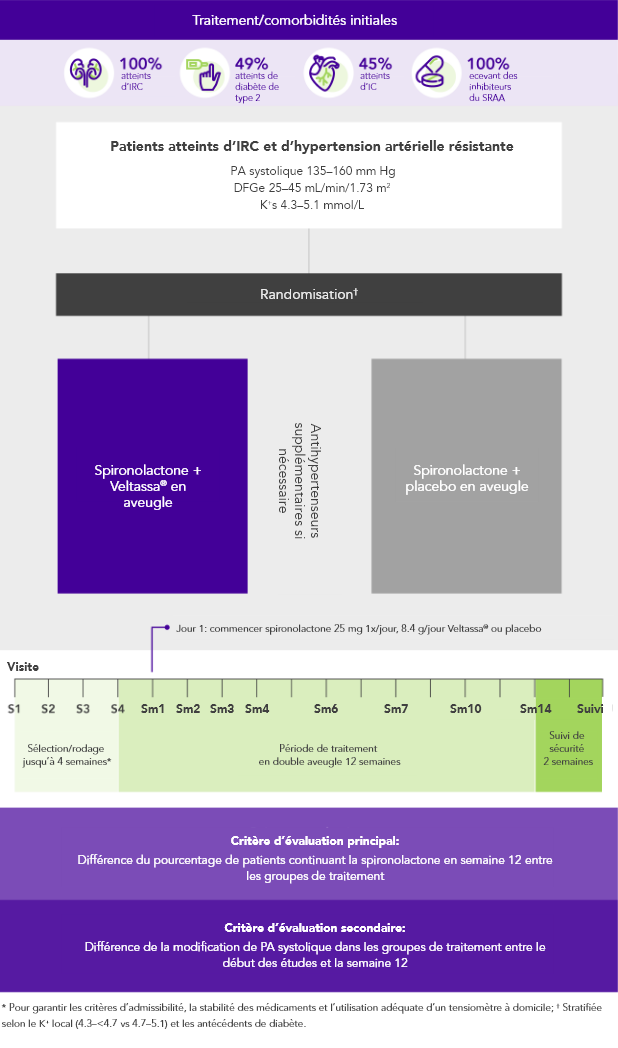
AMBER (N=295)5
100% IRC ; 45% IC; 49% diabète de type 2;
100% sous inhibiteurs du SRAA
Pourcentage de patients poursuivant la spironolactone en semaine 12
(critère d’évaluation principal)
![]()
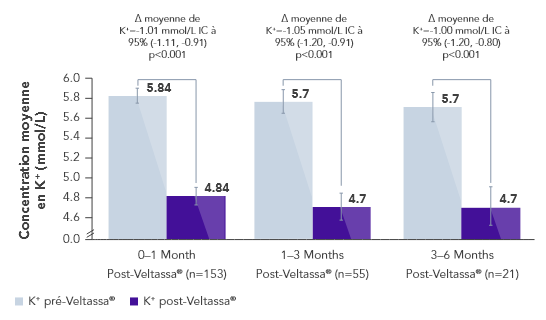
Dans une étude rétrospective d’observation menée chez 288 patients hyperkaliémiques atteints d’IC, de diabète de type 2 ou d’IRC, Veltassa® a diminué le K+ sérique en moyenne de -1.0 mmol/L vs avant le traitement (p<0.001).6
Dans la même étude, le traitement par inhibiteurs du SRAA a été poursuivi chez ~80% des patients pendant 6 mois.6
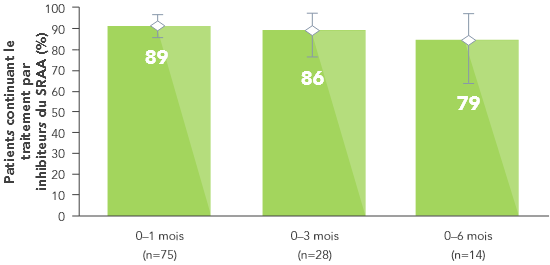
De même, dans une grande base de données de santé des États-Unis comprenant des patients atteints d’hyperkaliémie, les patients recevant Veltassa® ont été plus nombreux à continuer le traitement par inhibiteurs du SRAA que ceux recevant un chélateur de K+ différent (polystyrènesulfonate sodique) ou aucune substance de ce type.7
Le traitement par Veltassa® était aussi associé à moins d’hospitalisations et de visites aux urgences.7








![]()
![]()
EFFETS INDÉSIRABLES DANS LES ÉTUDES CLINIQUES
| Classe de systèmes d’organes | Fréquents | Peu fréquents |
|---|---|---|
Troubles du métabolisme et de la nutrition |
Hypomagnésémie: 5.3% |
|
Affections gastro-intestinales |
Constipation: 6.2% Diarrhée: 3% Douleurs abdominales: 2.9% Flatulences: 1.8% |
Nausées Vomissements |
![]()
![]()
Le profil de sécurité favorable observé dans les essais cliniques est appuyé par des preuves issues des études en conditions réelles.
Swissmedicinfo.ch/Veltassa présente les médicaments dont l’interaction avec Veltassa a été évaluée et les recommandations concernant leur administration en concomitance avec Veltassa. Pour des raisons de prudence, un intervalle d’au moins 3 heures devrait être respecté entre la prise de patiromer et celle de médicaments par voie orale non mentionnés.
![]()
![]()
99.4%
recevaient des
inhibiteurs du
SRAA au début
de l’étude
![]()
72.8%
présentaient
un diabète
![]()
81.2%
avaient une IRC
et un DFGe
<60 mL/min/1.73 m2
icône
![]()
48.7%
avaient une IC



Ca2+, ions calcium; GI, gastrointestinal; EI, événements indésirables; BB, bêta-bloquant; BID, deux fois par jour; ICC, insuffisance cardiaque chronique; IC, intervalle de confiance; IRC, insuffisance rénale chronique; DFG(e), débit de filtration glomérulaire (estimé); mmol/L, millimoles par litre; sK+, potassium sérique; SRAA, système rénine-angiotensine-aldostérone;
aMoyennes des moindres carrés (IC 95 %) des taux de potassium sérique sur 52 semaines et pendant le suivi post-traitement chez les patients présentant une hyperkaliémie légère ou modérée (modèles à effets mixtes post-hoc pour l'analyse des mesures répétées).1
bAu jour 3 du traitement, 202 patients présentaient une hyperkaliémie légère et 82 une hyperkaliémie modérée.
cAu troisième jour de suivi, 163 patients présentaient une hyperkaliémie légère et 58 une hyperkaliémie modérée.
dAu cours de la première semaine de suivi, 154 patients présentaient une hyperkaliémie légère et 57 une hyperkaliémie modérée.
eAu cours de la troisième semaine de suivi, 126 patients présentaient une hyperkaliémie légère et 48 une hyperkaliémie modérée.
fLa dose initiale recommandée de Veltassa® est de 8,4 g une fois par jour. La dose quotidienne peut être augmentée ou diminuée de 8,4 g si nécessaire pour atteindre l'objectif souhaité, jusqu'à une dose maximale de 25,2 g par jour.8
1. Bakris GL, et al. JAMA 2015;314(2):151−61. 2. Weir MR, et al. N Engl J Med 2015;372(3):211−21. 3. Bushinsky DA, et al. Kidney Int 2015;88(6):1427−33. 4. Pitt B, et al. Eur Heart J 2011;32(7):820−8. 5. Agarwal R, et al. Lancet 2019;394(10208):1540−50. 6. Kovesdy CP, et al. Postgrad Med 2020;132:176–83. 7. Desai NR, et al. PLoS One 2020 Jan 7;15(1):e0226844. doi: 10.1371/journal.pone.0226844. 8. Information professionnelle Veltassa®: www.swissmedicinfo.ch. 9. Li L, et al. J Cardiovasc Pharmacol Ther 2016;21(5):456−65. 10. Pitt B, et al. ESC Heart Fail 2018;5(4):592−602. 11. Seferovic PM, et al. Eur J Heart Fail 2019;21:1169–86. 12. KDIGO Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease Kidney Int 2020;98(Suppl 4S):S1–S116.