Unerwünschte Ereignisse berichten:
Unerwünschte Ereignisse müssen der CSL Vifor Group gemeldet werden.
pv.vif@viforpharma.com

I am practicing from:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other
I am residing in:

Austria

Austria

Belgium

Germany

Ireland

Italy

Netherlands

Portugal

Spain

Switzerland
Other

Bitte verwenden Sie als Benutzernamen die E-Mail Adresse, welche Sie bei der Registration angegeben hatten. Falls Sie das Passwort vergessen haben, können Sie sich einen Reaktivierungslink zustellen lassen. Alternativ ist für bereits registrierte Health Professionals auch eine Anmeldung mit der HPC-Card von FMH oder pharmaSuisse möglich.
Zuverlässige Kontrolle des Kaliumspiegels rund um die Uhr für die nachweislich leitlinienkonforme Therapie mit RAAS-Inhibitoren Ihrer Patienten1-11
Unerwünschte Ereignisse müssen der CSL Vifor Group gemeldet werden.
pv.vif@viforpharma.com
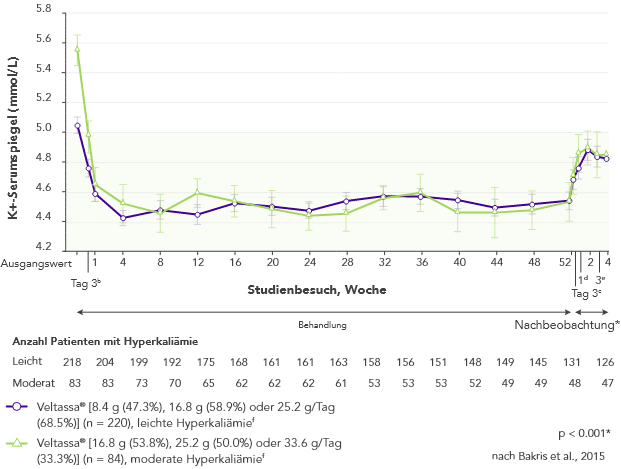


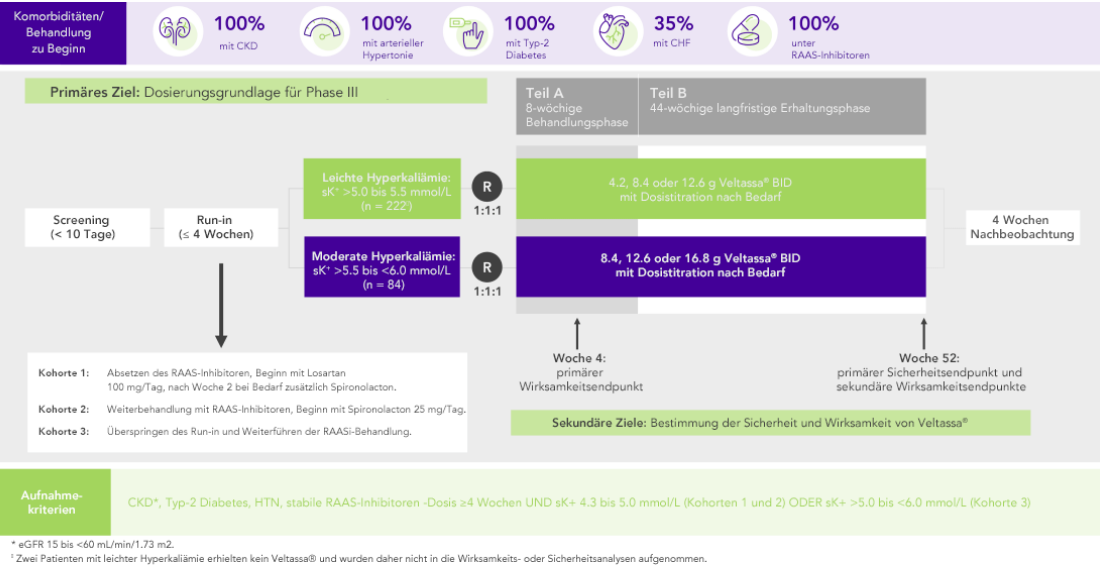
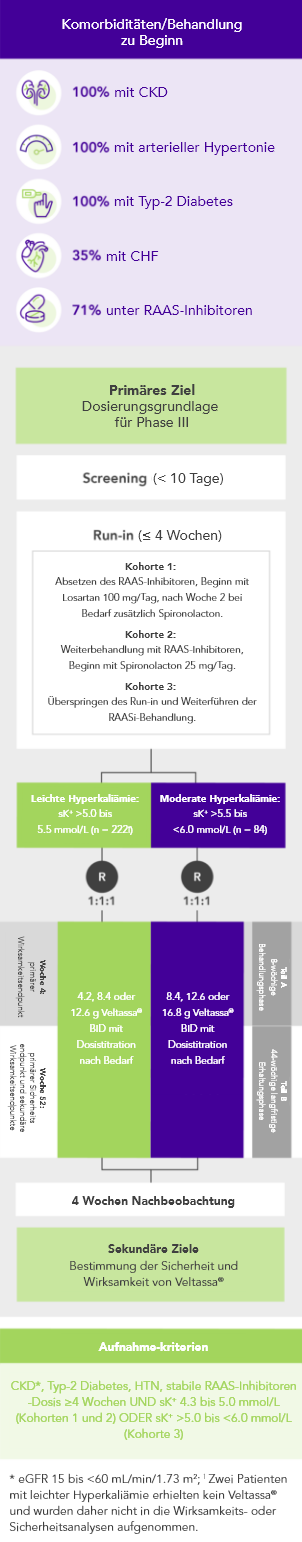
Bei 306 Patienten mit Typ-2 Diabetes, CKD und arterieller Hypertonie, die mit RAAS-Inhibitoren behandelt wurden, war der K+-Serumspiegel nach vier Wochen mit Veltassa® signifikant niedriger. Dieser Zustand wurde ein Jahr lang aufrecht erhalten bei:
![]()
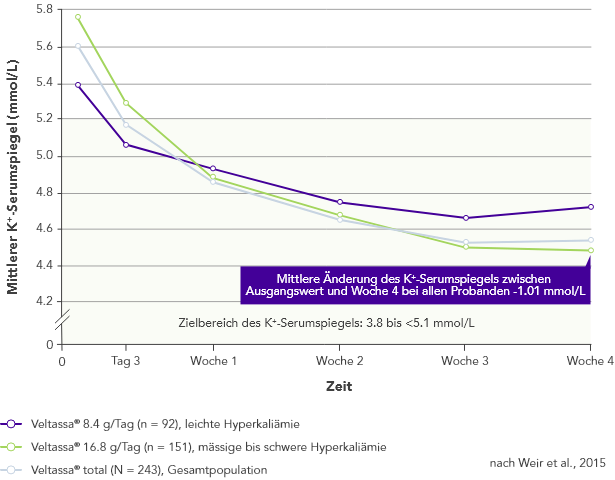

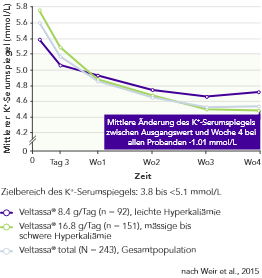
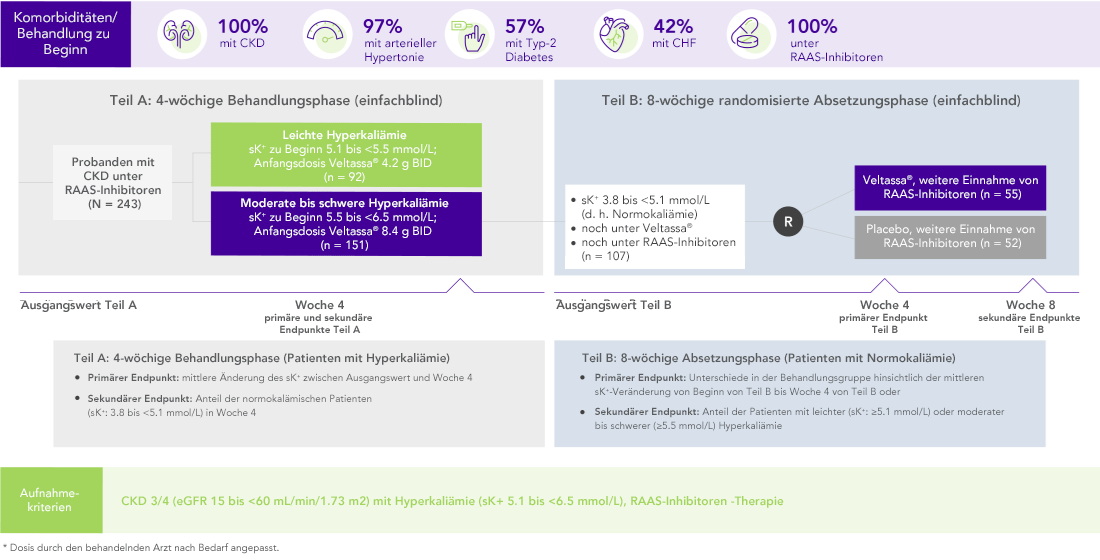
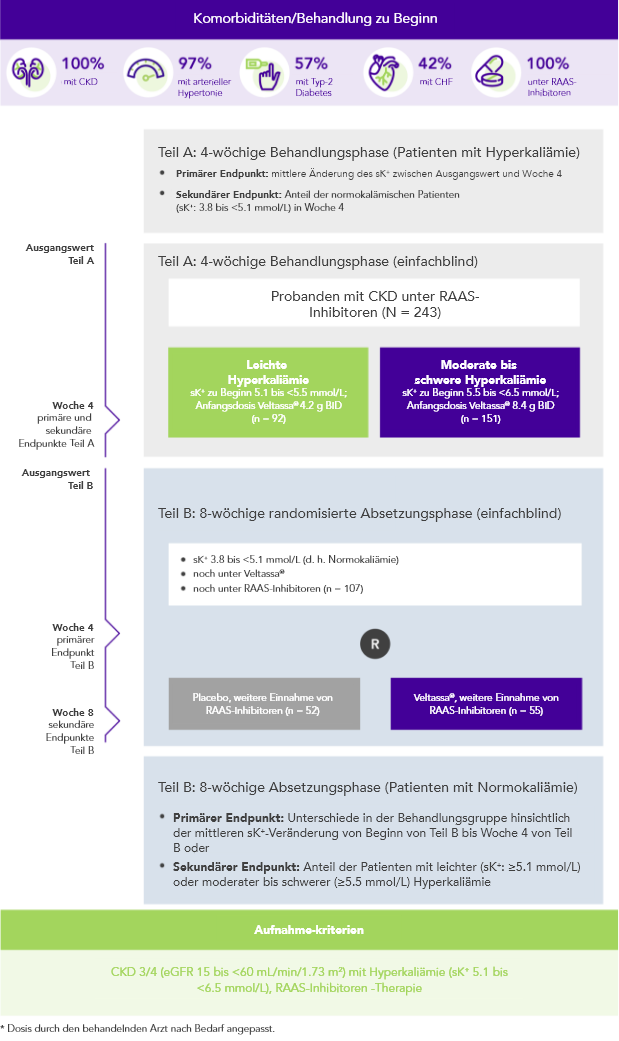
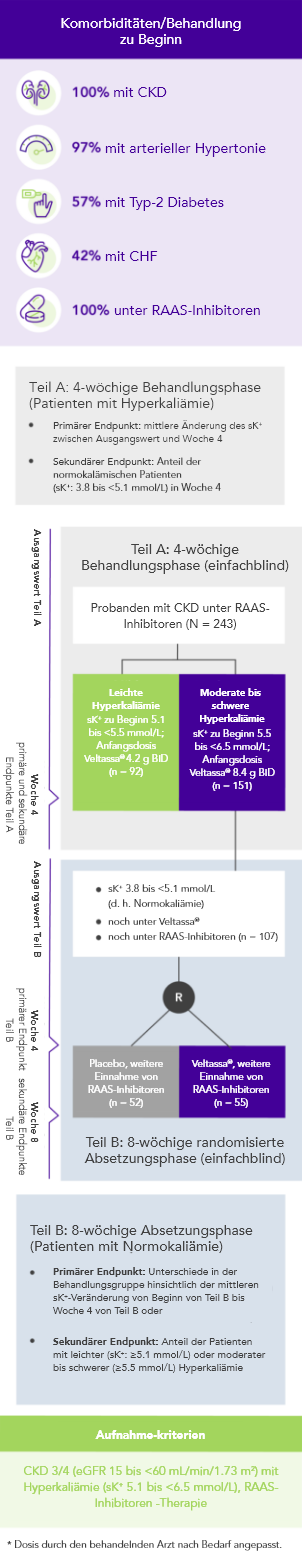
Von 243 Patienten mit CKD und Hyperkaliämie, die RAAS-Inhibitoren erhielten, hatten 76% in Woche 42 K+-Serumspiegel im Zielbereich (3.8 bis < 5.1 mmol/L).
Ähnliche Ergebnisse bei Patienten mit:
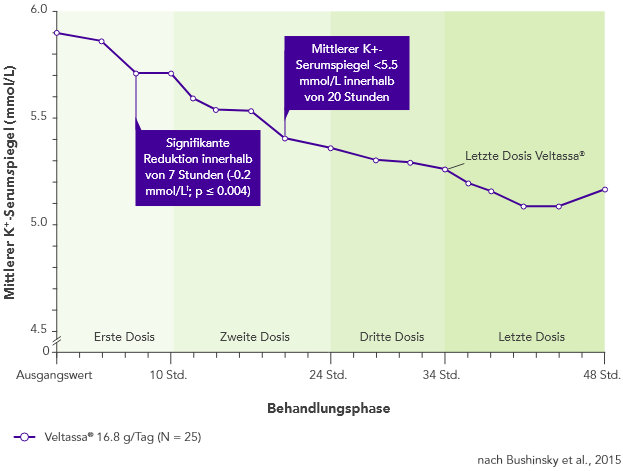

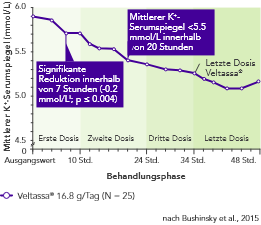
Veltassa® senkte den K+-Serumspiegel bei mit RAAS-Inhibitoren behandelten Patienten mit CKD und Hyperkaliämie innerhalb von vier bis sieben Stunden nach der ersten Dosis ab.3 Zu allen folgenden Zeiten war der ursprüngliche mittlere K+-Serumspiegel über einen Zeitraum von 48 Stunden reduziert.
Der K+-Serumspiegel stieg vor der jeweils nächsten Dosis oder innerhalb von 24 Stunden nach der jeweils letzten Dosis nicht an.3
OPAL (N=243)2
100% unter Therapie mit RAAS-Inhibitoren; 42% HF;
100% CKD; 97% arterieller Hypertonie; 57% Typ-2 Diabetes
Anteil der Patienten, die in Woche 8 der randomisierten Absetzungsphase eine Dosis von RAAS-Inhibitoren erhielten
(exploratorischer Endunkt)
![]()
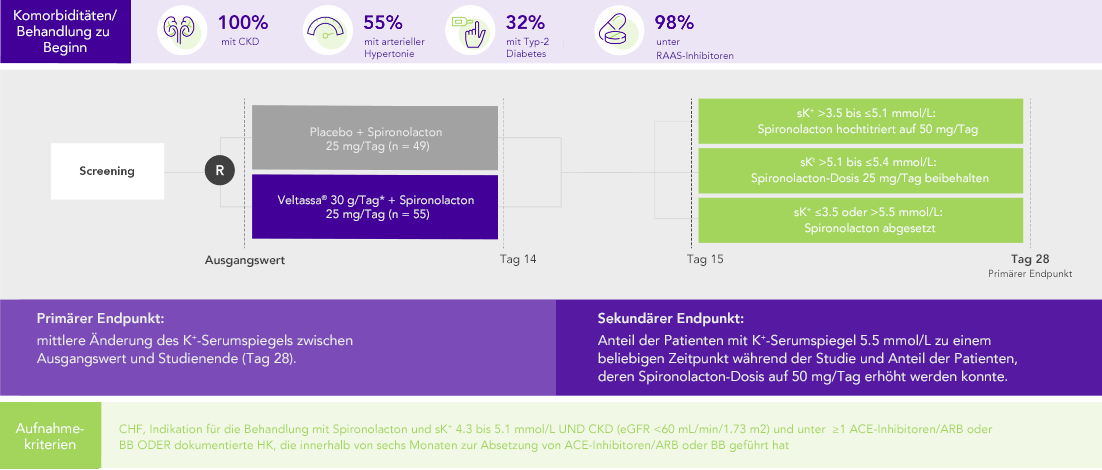
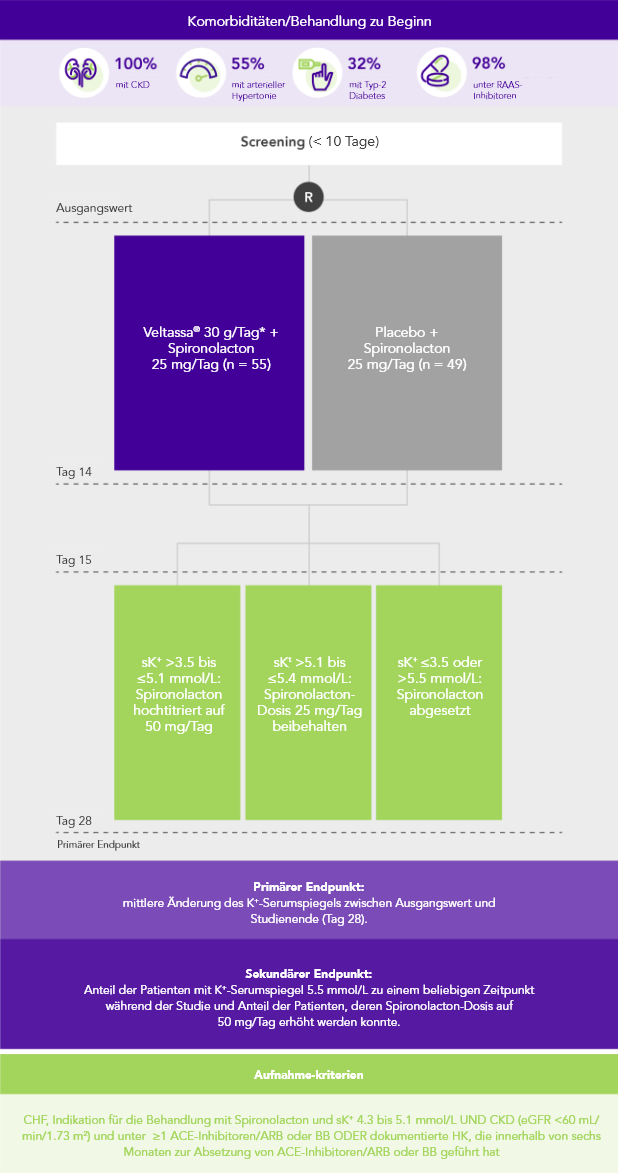
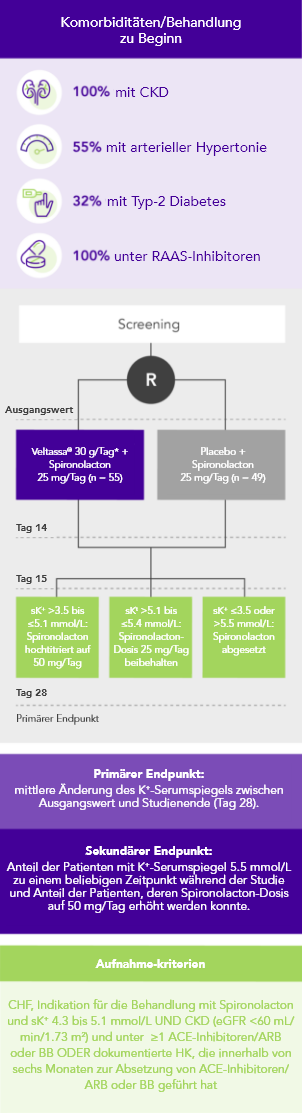
PEARL-HF (N=105)4
100% HF; 57% CKD; 32% Typ-2 Diabetes;
98% unter Therapie mit RAAS-Inhibitoren
Anteil der Patienten, die auf Spironolacton 50 mg/Tag hochtitriert wurden
(sekundärer Endpunkt)
![]()
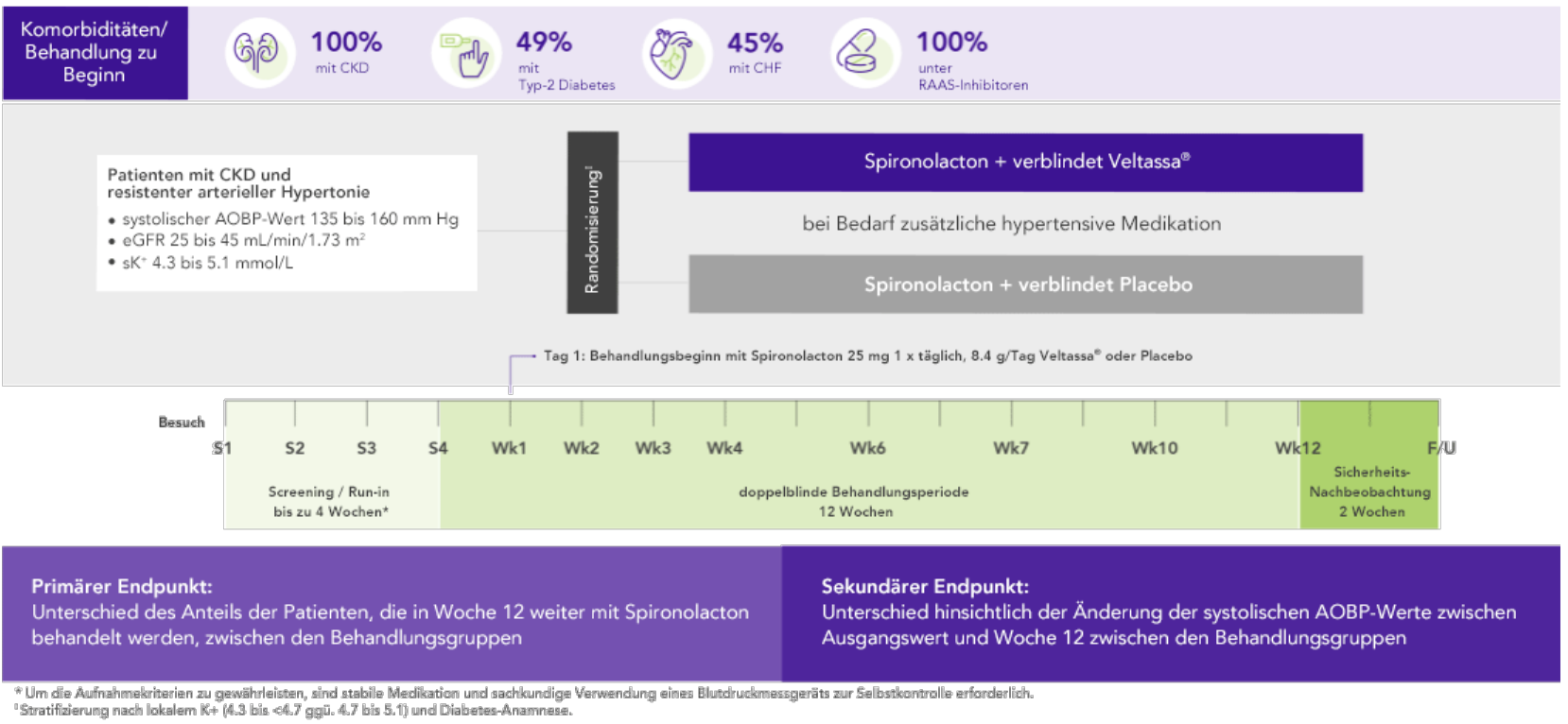
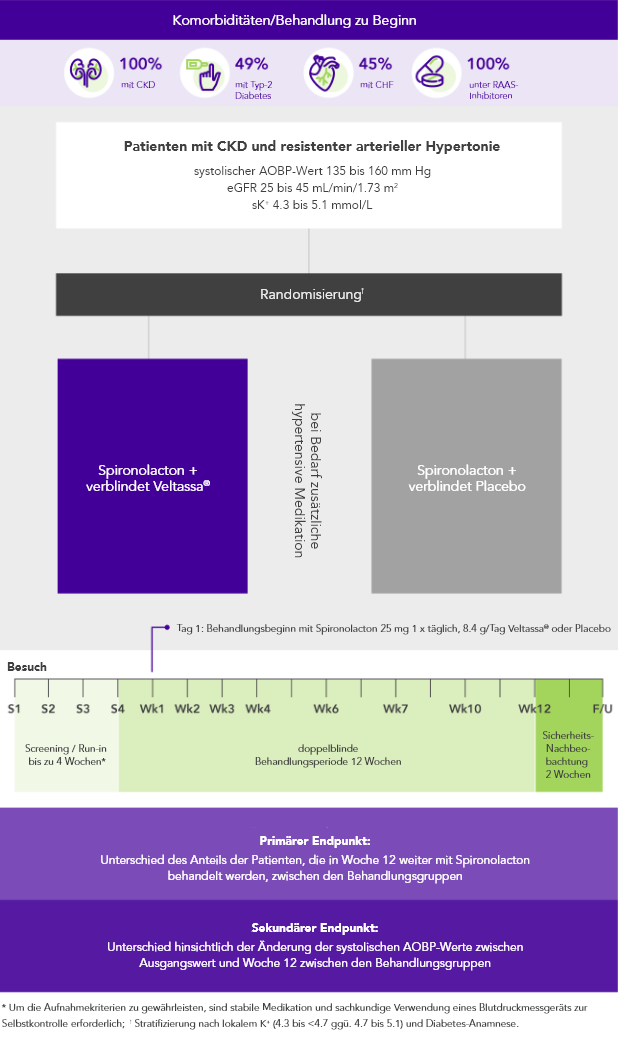
AMBER (N=295)5
100% CKD; 45% HF; 49% Typ-2 Diabetes;
100% unter Therapie mit RAAS-InhibitorenRAASi
Anteil der Patienten, die in Woche 12 weiter mit Spironolacton behandelt wurden
(primärer Endpunkt)
![]()
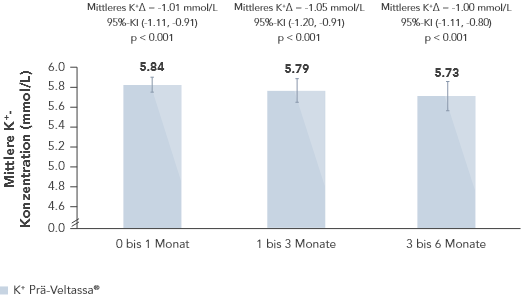
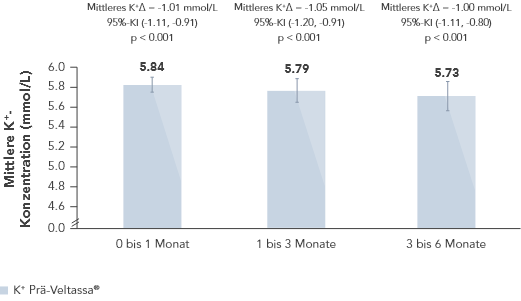
Veltassa® reduzierte in einer retrospektiven Beobachtungsstudie mit 288 Hyperkaliämie-Patienten mit HF, Typ-2 Diabetes oder CKD den K+-Serumspiegel gegenüber dem Wert vor Behandlungsbeginn um durchschnittlich 1.0 mmol/L (p < 0.001).6
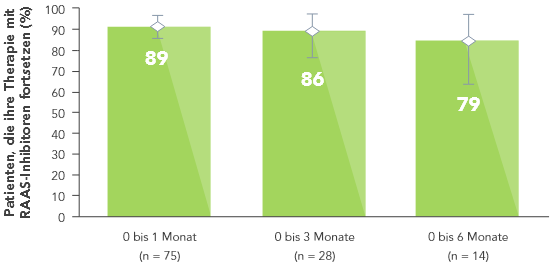
Die Therapie mit RAAS-Inhibitoren wurde in der gleichen Studie bei rund 80% der Patienten während eines Zeitraums von sechs Monaten fortgesetzt.6
Ähnliches geht aus einer grossen Datenbank des US-Gesundheitswesens hervor: Hyperkaliämie-Patienten, die Veltassa® erhielten, setzten ihre Therapie mit RAAS-Inhibitoren häufiger fort als Patienten, die einen anderen Kaliumbinder (Natriumpolystyrolsulfonat) oder keinen Kaliumbinder erhielten.7
Die Behandlung mit Veltassa® war ausserdem mit weniger Hospitalisierungen und Besuchen der Notaufnahme assoziiert.7




![]()
![]()
UAW IN KLINISCHEN STUDIEN
| Systemorganklasse | Häufig | Selten |
|---|---|---|
Stoffwechsel- und Ernährungsstörungen |
Hypomagnesaemia: 5.3% |
|
Gastrointestinal disorders |
Verstopfung: 6.2% Durchfall: 3% Bauchschmerzen: 2.9% Blähungen: 1.8% |
Übelkeit Erbrechen |
![]()
![]()
Swissmedicinfo.ch/Veltassa stellt die Arzneimittel vor, deren Wechselwirkung mit Veltassa geprüft wurde, sowie Empfehlungen zu deren gleichzeitiger Verabreichung mit Veltassa. Aus Gründen der Vorsicht sollte zwischen der Einnahme von Patiromer und nicht aufgeführten oralen Arzneimitteln ein Abstand von mindestens 3 Stunden eingehalten werden
![]()
![]()
99.4%
erhielten zu
Beginn RAAS-
Inhibitoren
![]()
72.8%
litten an
Diabetes
![]()
81.2%
litten an CKD mit
eGFR < 60 mL/min/
1.73 m2 Symbol
![]()
48.7%
litten an HF


ACE, Angiotensin-II-konvertierendes Enzym; AOBP, automated office blood pressure; ARB, Angiotensin-II-Rezeptor-Blocker; BB, Betablocker; Ca2+, Kalzium-Ionen; CKD, Chronischer Niereninsuffizienz (chronic kidney disease); (e)GFR, (geschätzte) glomeruläre Filtrationsrate; GI, gastrointestinal; HF, Herzinsuffizienz (heart failure); HK, Hyperkaliämie; K+, Kalium-Ionen; KI, Konfidenzintervall; mmol/L, Millimol pro Liter; RAAS, Renin−Angiotensin−Aldosteron-System; sK+, Serum-Kalium; UAW, unerwünschte Arzneimittelwirkung; UE, unerwünschtes Ereignis;
aKleinste Quadrate des mittleren Serumkaliumspiegels (95 % KI) über 52 Wochen und während der Nachbeobachtung bei Patienten mit leichter oder mittelschwerer Hyperkaliämie (post-hoc Mixed-Effects-Modelle für die Analyse wiederholter Messungen).
bAm Behandlungstag 3 gab es 202 Patienten mit leichter Hyperkaliämie und 82 mit moderater Hyperkaliämie.
cAm Folgetag 3 gab es 163 Patienten mit leichter Hyperkaliämie und 58 mit moderater Hyperkaliämie.
dBei der Nachuntersuchung in Woche 1 gab es 154 Patienten mit einer leichten Hyperkaliämie und 57 mit einer moderaten Hyperkaliämie.
eBei der Nachuntersuchung in Woche 3 gab es 126 Patienten mit leichter Hyperkaliämie und 48 mit mäßiger Hyperkaliämie.
fDie empfohlene Anfangsdosis von Veltassa® beträgt 8,4 g einmal täglich. Die Tagesdosis kann bei Bedarf um 8,4 g erhöht oder verringert werden, um den gewünschten Zielbereich zu erreichen, bis zu einer Maximaldosis von 25,2 g täglich.8
1. Bakris GL, et al. JAMA 2015;314(2):151−61. 2. Weir MR, et al. N Engl J Med 2015;372(3):211−21. 3. Bushinsky DA, et al. Kidney Int 2015;88(6):1427−33. 4. Pitt B, et al. Eur Heart J 2011;32(7):820−8. 5. Agarwal R, et al. Lancet 2019;394(10208):1540−50. 6. Kovesdy CP, et al. Postgrad Med 2020;132:176–83. 7. Desai NR, et al. PLoS One 2020 Jan 7;15(1):e0226844. doi: 10.1371/journal.pone.0226844. 8. Fachinformation Veltassa®: www.swissmedicinfo.ch. 9. Li L, et al. J Cardiovasc Pharmacol Ther 2016;21(5):456−65. 10. Pitt B, et al. ESC Heart Fail 2018;5(4):592−602. 11. Seferovic PM, et al. Eur J Heart Fail 2019;21:1169–86. 12. KDIGO Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease Kidney Int 2020;98(Suppl 4S):S1–S116.